Пресса об РФФИ
Раскрыт механизм переноса натрия через мембранную стенку под воздействием света
Научно-популярный журнал Naked Science (г. Москва), 21.05.2020
Дата публикации: 08.09.2020
Международная группа учёных впервые получила структуру светочувствительного белка-транспортёра натрия KR2 в активном состоянии. Это позволило описать механизм переноса ионов натрия через клеточную мембрану под воздействием света.Работа учёных опубликована в одном из самых престижных научных журналов – Nature Communications.
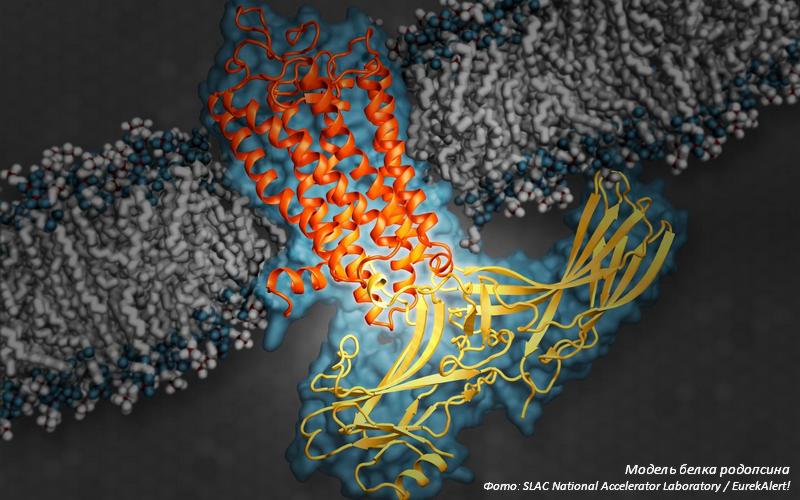
KR2 принадлежит к огромному семейству микробных родопсинов – светочувствительных белков, находящихся в клеточной мембране архей, бактерий, вирусов и эукариот. Эти белки способны выполнять широкий спектр функций, но наиболее интересной является перенос различных ионов через мембрану под воздействием света.
Именно такие ионные каналы и насосы являются инструментами оптогенетики – одной из самых актуальных биомедицинских дисциплин, позволяющей управлять активностью различных типов клеток организма при облучении их светом. Широкую известность оптогенетика обрела благодаря значительному вкладу в развитие методов минимально инвазивных исследований мозга, а также лечения таких нейродегенеративных заболеваний, как болезни Альцгеймера, Паркинсона, и других. Более того, сегодня оптогенетика позволяет восстанавливать потерянные слух, зрение и мышечную активность.
Поиск новых, более селективных белков для оптогенетики является приоритетным направлением в этой области исследований. Родопсин KR2, найденный в 2013 году, является уникальным оптогенетическим инструментом, так как позволяет при физиологических условиях избирательно переносить через клеточную мембрану исключительно ионы натрия. Понимание механизмов его работы очень важно для оптимизации функциональных характеристик этого белка, а также для создания на его основе новых оптогенетических инструментов.
Биофизики МФТИ в 2015 и 2019 годах опубликовали первые структуры KR2 в различных формах. В том числе они показали, что белок формирует пентамеры, находясь в мембране. Более того, образование таких комплексов необходимо для функционирования родопсина. Однако во всех описанных авторами моделях белок находился в неактивированном, то есть основном состоянии.
Для понимания принципов транспорта ионов через мембрану была необходима также структура активного состояния белка, так как натрий переносится родопсином только после активации последнего светом. Именно такая кристаллическая структура высокого разрешения и была получена и описана учёными.
«Изначально мы использовали классический подход, активируя KR2 в заранее выращенных белковых кристаллах, освещая их лазером и фиксируя активное состояние путём быстрой заморозки кристалла при 100К, — рассказывает первый автор работы, аспирант МФТИ Кирилл Ковалёв. — Нам повезло, ведь зачастую подобные манипуляции приводят к разрушению кристаллов. Для избежания этого нам пришлось аккуратно подбирать длину волны и мощность лазерного излучения, а также регулировать время засветки».
Такие эксперименты требуют большого количества белковых кристаллов высокого качества. Уникальное оборудование Центра исследований молекулярных механизмов старения и возрастных заболеваний МФТИ позволило провести массивную кристаллизацию родопсина KR2.
Наиболее значимой находкой исследователей стала идентификация аминокислотных остатков белка, связывающих ион натрия внутри молекулы KR2. Именно они определяют селективность родопсина к определённому типу ионов. Кроме того, структура активного состояния высокого разрешения (2.1Å) позволила определить точную конфигурацию сайта связывания иона натрия в активном центре белка.
Учёные впервые показали, что сайт связывания, образуемый KR2, идеально оптимизирован к ионам натрия в ходе эволюции родопсинов. Таким образом, именно полученная структура активного состояния должна использоваться для рационального дизайна оптогенетических инструментов нового поколения на основе KR2.
«Транспорт ионов через мембранную стенку – фундаментальный биологический процесс. При этом перенос ионов натрия должен иметь принципиально иной механизм, чем таковой для протонов, — поясняет Валентин Горделий, директор исследований в Институте структурной биологии в Гренобле и научный координатор Центра исследований молекулярных механизмов старения и возрастных заболеваний в МФТИ. — Мы впервые увидели, как ион натрия связывается внутри молекулы родопсина, а также показали механизм выброса ионов в межклеточное пространство».
Авторы уверены, что результаты их работы не только раскрывают фундаментальные принципы, лежащие в основе ионного транспорта через клеточную мембрану, но и имеют практическую пользу для нужд оптогенетики. Учёные МФТИ продолжают разработку оптимизированных форм белка KR2 для расширения арсенала методов изучения головного мозга и лечения нейродегенеративных заболеваний.
В работе принимали участие учёные из Московского физико-технического института (МФТИ), Института структурной биологии Гренобльского университета и Европейского ускорительного комплекса в Гренобле (Франция), Юлихского исследовательского центра, Аахенского университета, Института Макса Планка, Европейской лаборатории молекулярной биологии (Германия), а также источника синхротронного излучения ALBA (Испания). Работа была поддержана Министерством науки и высшего образования РФ и Российским фондом фундаментальных исследований.
Источник: Naked Science
Фото: SLAC National Accelerator Laboratory / EurekAlert!